le RÉDOX, l’oxydo-réduction, le rH2
Le rédox, une notion complètement ignorée, voir déniée dans les analyses de l’eau.
L'oxydoréduction qu’est-ce que c’est ? C’est un phénomène tout ce qui a de plus banal dans lequel l'oxygène, oxydant puissant, brûle de l’hydrogène un carburant, et dont le produit de réaction est de l’eau. Il ne se produit jamais de réaction d'oxydation sans qu'il se produise en même temps une réaction de réduction ; c'est pourquoi l'on parle de phénomène d'oxydoréduction : l’hydrogène est oxydé et l’oxygène est réduit, le produit, l’eau, est chimiquement neutre et stable.
Par souci de simplification, on appellera ici oxydation une réaction au cours de laquelle une matière se combine à de l'oxygène, et réduction une réaction au cours de laquelle un composé perd de l'oxygène.
L’Oxyde hydrique, ou l’hydrate d'oxygène, c’est de l’eau.
De la même façon que l'eau, en tant que solvant actif, se comporte comme un acide vis-à-vis d'une base et comme une base vis-à-vis d'un acide, avec les oxydants et les réducteurs, l'eau est donc elle-même un système rédox capable de donner, ou de capter, les électrons des substances qu'on y dissout.
Dans ce sens, toute solution aqueuse, quelle que soit sa composition chimique, peut être assimilée à l'électrolyte d'une électrode d'hydrogène, c’est le rH2 (2), c'est d'ailleurs le premier postulat de la bio-électronique (3).
Indépendamment de la valeur de son pH, dont l’équilibre acido-basique est égal à 7, une solution aqueuse n'est ni oxydante, ni réductrice (anti-oxydante) lorsque son rH2 est égal à 28. Cf.(1)
0 < rH2 < 28
Une solution dont le rH2 est situé entre 0 et 28 est dite réductrice ou anti-oxydante, appelé aussi « anaérobie ». Dans un tel milieu, l'activité d'oxygène [O2] étant très faible, les bactéries s'y développant ont une action chimiquement réductrice. Un exemple typique de ce que l’on souhaite éviter dans le compostage (Cf. toilettes sèche, fertilisation) est la présence d'une culture d’organisme symbiotique (Azobacter) susceptible de réduire en milieu anaérobie les ions nitrate NO3-, en azote atmosphérique N2. En épuration des eaux, on appelle cela « dénitrification anaérobie ».
28 < rH2 < 42
Lorsque la valeur du rH2 est comprise entre 28 et 42, la solution est dite oxydante, en « aérobiose ». L'activité d'oxygène y étant plus élevée, ce sont d'autres types de bactéries qui s'y développent. En fait, chaque espèce de bactérie, virus ou de champignon microscopique a un domaine bien défini de pH et de rH2 dans lequel il peut se développer.
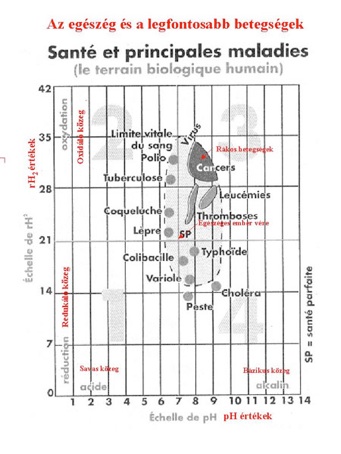
En dehors de leur domaine de pH et de rH2, ces êtres microscopiques meurent. Dans un système de coordonnées cartésiennes, on peut porter les valeurs du rH2 en fonction du pH pour obtenir un espace à deux dimensions, dans lequel le domaine d'existence de chaque bactérie ou de virus peut être délimité. On obtient ainsi une carte d'activité virale et bactérienne où chaque espèce occupe une place bien définie.
Ici le diagramme dit de Vincent du nom du chercheur du même nom le Professeur Louis-Claude Vincent. (3)
On peut comprendre là, selon ce diagramme qu'une modification même modeste du rH2 du sang aura une influence décisive sur la possibilité de développement ou de disparition d’une bactérie ou d’un virus donné. Les applications médicales de l'électrochimie ouvrent ici des horizons prometteurs. En fait, la valeur du rH2 du sang a aussi une influence décisive sur les potentiels électriques qui s'établissent à l'intérieur des cellules entre le noyau et le cytoplasme, ainsi qu'entre le cytoplasme et les liquides intercellulaires. Ces potentiels régulent aussi la division cellulaire, donc la genèse potentielle des cellules cancéreuses.
La notion du rH2 n'est malheureusement pas enseignée dans les écoles, ni dans la plupart des facultés universitaires. Pourtant, l'ignorance de cette notion, lors de la perception et l'évaluation des phénomènes liés aux réactions de transferts d'électrons e- et de protons H+, peut induire en erreur même les spécialistes.
Dans le domaine de la santé, cette notion-clef permet de comprendre et d'expliquer l'apparition d'un certain nombre de maladies graves et de tracer de nouvelles pistes de recherches pour le traitement de ces maladies.
-
(1)rédox neutre égal 28 (Cf. « L'eau en tant que système redox » József Országh, Éditions Arys, Paris, Volume 2, pages 81-97 (1991))
-
Dans les réactions rédox, le milieu de référence est l'eau chimiquement pure dans laquelle les activités d'hydrogène [H2] et d'oxygène [O2] se répartissent dans les proportions de : un d’oxygène pour : deux d’hydrogène : [H2] = 2 [O2]. Calculons donc le rH2 de l'eau chimiquement pure. Pour cela, dans l'équation (6), remplaçons [O2] par ½[H2] :
-
Ke = ½ [H2]3 = 10-84 (6)
-
d'où l'on tire l'activité d'hydrogène dans l'eau pure : [H2] = 10-27,7 que les chimistes arrondissent à 10-28.
-
Le rH2 de l'eau pure est donc -log10-28 = 28. C'est ce qu'on appelle le point de « neutralité rédox » ou « indifférence rédox ».
-
Le rédox a été découvert en 1920, par W. Mansfield Clark qu’il a appelé notion « rH ». Le symbole rH2 – qui reflète mieux la réalité – n'est apparu que dans les années 1940. Oxidation-reduction potentials of organic systems - William Mansfield Clark - Google Livres
-
(2)Cf. communications scientifiques de József Országh parues dans la revue Sciences du vivant (Éditions Arys, Paris) : Réactions oxydo-réduction et acido-basiques : Vers une approche théorique et expérimentale plus cohérente. Volume 1, pages 23-34 (1990), « L'eau en tant que système redox ». Volume 2, pages 81-97 (1991)
-
(3)Cf. Principes-Bioélectroniques Louis Claude Vincent.
-
Cf. la bioélectronique selon LC Vincent - delvaux
-
Cf. la thèse de doctorat en médecine, par le Dr Ropers « Contribution aux applications médicales des facteurs pH, rH2, r selon la méthode Vincent », Université de Nantes (1978).
-
Cf. professeur Antoine Béchamp, Analyse qualitative et quantitative de l'eau minérale alcaline gazeuse de Soultzmatt, éd. Imprim. Huder, 1853, Le polymorphisme bactérien et la mystification de Louis Pasteur, Vaccinations : les avis convergents de médecins et de scientifiques prestigieux
-
Cf. La bioélectronique pratique - pH et antioxydants - Pratique de la biologie électronique dans la médecine et dans l'alimentation de Giralt-Gonzalez (José) Editions du Dauphin Fercé sur Sarthe 1999 Book Condition, 1 vol. - 253 pages
eau potable, buvable et biocompatible, notion :
En France, en violation de la loi relative à la protection de la vie privée, l'administration a un droit de regard sur la qualité de l'eau qui se trouve dans le verre du consommateur non raccordé au réseau de distribution d'eau ! En toute démocrature, bien entendue !
La loi est simple elle passe obligatoirement par la désinfection chimique, par principe de précaution.
L'idée suivant laquelle il faut à tout prix consommer de l'eau ne contenant pas de bactéries réputées pathogènes détermine les normes légales pour l'eau potable. Les normes bactériologiques imposent l'absence absolue de colibacille (bactérie dite de contamination fécale). Lesquelles normes rendent la désinfection chimique incontournable.
Ce qu’en dit le site eautarcie :
-
À notre connaissance, les limites de la présence des bactéries n'ont jamais été déterminées par des études épidémiologiques, mais en fonction de la possibilité industrielle offerte par la désinfection chimique.
-
Pourtant, une eau biocompatible peut contenir un petit nombre de bactéries (une dizaine par 100 ml) de colibacille et une centaine de germes communs. Cette quantité de bactéries est très bien tolérée par l'organisme humain.
-
D'après les connaissances scientifiques actuelles, on peut proposer des valeurs guides, contrairement à des normes rigides pour l'eau dont la consommation prolongée ne peut en principe porter de préjudice à la santé.
-
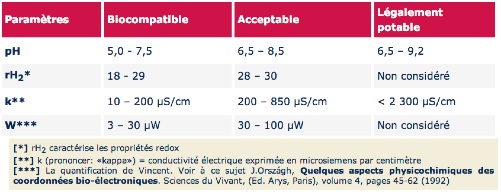
Quant aux normes physicochimiques, elles sont plus sévères que dans l'eau légalement potable. Le tableau suivant montre des valeurs guides pour une eau biocompatible. Il ne s'agit nullement de normes légales, mais des propositions à débattre.
-
-
-
-
-
-
mesurer le potentiel rédox ?
L'ORP chez les anglo-saxons (Oxydation Reduction Potential), qui est le potentiel de réduction d'oxydation PRO.
Pour mesurer le potentiel rédox ou PRO d'une solution, on y plonge une électrode de platine (inerte vis-à-vis de l'eau) et une électrode de référence dont le potentiel est stable et ne dépend pas de la nature de la solution. La mesure d’exprime en volts (ou en millivolts). Il est généralement admis que plus le potentiel rédox est élevé plus la solution est « oxydante »; plus il est bas plus la solution est réductrice ou « anti-oxydante ».
Le potentiel rédox lu sur un instrument de mesure possède deux ambiguïtés, au point de vue électrochimique :
-
1.Le point zéro de l'échelle des potentiels n'est pas le potentiel zéro lu sur l'instrument de mesure. Ce potentiel ne représente nullement le point d'indifférence (ou neutralité) rédox d'une solution, au-dessus duquel la solution est oxydante et en en dessous réductrice. On mesure en fait la différence de potentiel qui se forme entre les électrodes et non le rédox. Dans l'écrasante majorité de cas, on utilise comme électrode de référence une électrode Ag/AgCl, argent/chlorure d'argent dont le potentiel est +200 millivolts (+0,2 Volt) par rapport à l'électrode normale d'hydrogène (0 Volt par définition). L'électrode de platine prend donc le potentiel de la solution, mais l'instrument de mesure affiche la différence de potentiel entre le rédox et le potentiel de l'électrode de référence. Il est donc tout à fait incorrect d'appeler potentiel rédox, la valeur affichée par le millivoltmètre. Explication détaillée ici : Théorie unitaire des réactions redox et acide-base
-
Sachant que, toute solution aqueuse, quelle que soit sa composition chimique, peut être assimilée à l'électrolyte d'une électrode d'hydrogène. Ce que l'on mesure donc dans une solution avec un millivoltmètre dépend à la fois du pH et du rH2. Pour se prononcer sur le caractère oxydant ou réducteur (antioxydant) d'une solution, uniquement sur base d'une mesure de potentiel rédox, sans tenir compte du pH de la solution, aboutit à des erreurs d'appréciation dans l'écrasante majorité des cas.
mesurer le rH2 réel en pratique ?
On se sert de la formule suivante :
Dans cette équation, E n'est autre que le PRO exprimé en Volt, pour une température de 25°C = 298K
Rappel important : nous l’avons vu plus haut, le rédox n'est pas la valeur indiquée par le millivoltmètre relié à une électrode rédox (électrode de platine), mais la différence de potentiel entre une électrode de platine plongée dans la solution à mesurer et l'électrode de référence argent/chlorure d'argent dont le potentiel, par rapport à l'électrode normale d'hydrogène, est de +200 millivolts à 25°C. Donc, pour obtenir la valeur correcte de potentiel rédox, désigné E dans la formule (14) aux valeurs lues sur l'instrument, il faut ajouter 200 mV.
Attention, dans les calculs E doit toujours être exprimé en unité SI, donc en Volt, soit 1 Volt = 1000 mV.
Voici 2 exemples de mesures sur des eaux minérales du commerce, fournis par eautarcie.org :
-
1.Le rH2 de l'eau minérale « Dasani » dont le pH est 3,04 et le potentiel mesuré par le millivoltmètre est +290 mV. La valeur PRO ou E s'obtient en ajoutant à +290 mV les 200 mV du potentiel de l'électrode de référence Ag/AgCl : donc E=290+200=490mV = 0,49 Volt; pH = 3,04. Introduisons ces valeurs dans l'équation (14), soit : rH2 = 33,8 x 0,49 + 2 x 3,04 = 22,6
-
En dépit de son caractère franchement acide, cette eau possède naturellement un caractère réducteur, ou antioxydant. 22,6 < 28
-
2.Le rH2 de l'eau minérale « Essentia » franchement basique, l'eau avec un pH = 9,26 et un potentiel mesuré de +179 mV = 0,179 Volt. Introduisons ces valeurs dans l'équation (14), soit : rH2 = 33,8 x (0,179 + 0,200) + 2 x 9,26 = 31,3.
-
Cette eau, en dépit de son caractère basique est par contre oxydante. 31,3 > 28
En basant son jugement uniquement sur des valeurs affichées par le millivoltmètre, on pourrait penser que « l'eau Dasani (+290 mV) est plus oxydante que l'eau Essentia (+179mV) » alors que c'est l'inverse qui est vrai.
eaux minérales en bouteille ?
L'eau de précipitation ne contient pas ou si peu de sels minéraux. Lors de la neutralisation du pH dans la citerne (dégradation du calcaire du ciment), elle ne s'en charge que très légèrement mais suffisamment pour être structurée par les ions ainsi créés.(5)
La fixation des sels minéraux par l'organisme est un processus complexe. Les marchands d’eau minérale en bouteille (plastique) mettent en avant la richesse des ces sels bienfaiteurs pour l’organisme, la croissance, les performances, etc, jusqu’à affirmer que la consommation de l'eau de pluie provoquerait une «déminéralisation» de l'organisme. Ce qu’il ne disent pas c’est que la presque totalité de ces sels est éliminée avec l'urine et la transpiration. Il serait plus juste de dire qu'une quantité à peu près équivalente de minéraux est éliminée ainsi. Les besoins en sels minéraux de l'organisme sont couverts par notre alimentation et non pas par l'eau que nous buvons. Le rôle principal de l'eau que nous buvons est de compenser les pertes hydrique par la transpiration, la respiration et par les déjections. Plus l'eau potable est chargée en sels minéraux, moins elle peut jouer ce rôle d'épuration et plus elle surchargera la fonction rénale. La plupart des eaux en bouteille sont passées aux rayons Gamma(7), le matériel génétique (les cadavres) des micros organismes détruits et irradiés sont bel et bien consommés, ne serait-ce pas une source mutagène possible...? tout comme la présence de nombreuses molécules médicamenteuse très stable chimiquement dispersée dans la nature en aval de nos stations d’épuration, donc les eaux d’infiltrations...
Les marchands d’eau minérale sont des empoisonneurs comme dirait le capitaine Haddok dans Tintin :
Ce qu’en dit le site eautarcie :
-
D'une manière globale, les sels minéraux contenus dans notre boisson ne participent pas à l'édification des tissus de l'organisme (ou d'une manière tout à fait marginale). Par contre, les ions provenant de la dissociation électrolytique des sels dissous dans l'eau peuvent y participer dans des processus biologiques sans être «assimilés». D'une manière générale, pour être assimilables, ces minéraux (ions) doivent être enveloppés (chélatés) par des molécules organiques. Ces ions chélatés ne se trouvent que dans notre alimentation, pas dans l'eau de boisson. Un bouillon de légumes, des fruits, des produits laitiers et de la viande constituent la source des sels minéraux assimilables. Les compléments alimentaires vendus en pharmacie pour combler le déficit en sels minéraux contiennent en fait des ions métalliques chélatés, donc bio-assimilables.
Si l'on pouvait assimiler le calcium ou le magnésium contenu dans une eau dure (contenant beaucoup de calcaire), cela serait la fin des maladies comme l'ostéoporose, la coxarthrose (arthrose de la hanche) ou les carences magnésiennes. De même la consommation d'eau ferrugineuse devrait mettre fin à l'anémie.
La médecine ne semble toujours pas confirmer ces assertions. De plus, la fixation des sels minéraux contenus dans l'eau de boisson n'a réellement lieu que pendant un jeûne hydrique prolongé dépassant une semaine. (6)
-
(5)Cf. E.M. Kosower, dans «Progress in Physical Organic Chemistry», vol. 3, Interscience, New York, 1965
-
(6)jeûne hydrique ou diète hydrique : abstention de tout aliment solide ou liquide, à l'exception de l'eau (sans laquelle on ne peut survivre), ne pas confondre avec jeûne sec
-
(7)Rayonnement ionisant ou «pasteurisation à froid» une technique de conservation et de décontamination des aliments qui consiste à soumettre ces derniers à un rayonnement ionisant de 200 à 2000 fois supérieur à la dose mortelle pour l'homme. Le bombardement de rayons gamma, permet de traiter de grandes quantité d'aliments. Ces techniques sont utilisées depuis les années 50. L'OMS a conclue en 1980 que "l'irradiation de toute denrée alimentaire jusqu'à une dose globale moyenne de 10 kGy (kilogray) ne présente aucun risque d'ordre toxicologique. Par conséquent, l'examen toxicologique des aliments ainsi traités n'est plus nécessaire. [...]. Et affirmait en 1999 que l'irradiation pouvait s'appliquer à "tout produit alimentaire à quelque dose ce soit". Voir études toxicologiques
En conclusion :
« Toutes les réactions chimiques qui font fonctionner les êtres vivants sont des réactions de transferts de protons (acide-base) et de transferts d'électrons (rédox).»